- Tensegridad y biotensegridadTensegridad y biotensegridad
- FasciaFascia
Tabla de contenidos
Composición de la fascia

Los tejidos conectivos que componen la fascia contienen básicamente en dos componentes, las células más la matriz extracelular (Figura 1.6). A diferencia de la mayoría de los otros tejidos, las células ocupan una parte muy pequeña del total volumen (generalmente menos del 5%), por lo que, casi todas las células de la fascia están inmersas en un abundante componente extracelular, una matriz altamente dinámica, que incluye los muchos tipos de colágeno, junto con las fibras de elastina y reticulina, así como las proteínas interfibrilares pegajosas comúnmente conocido como ‘sustancia fundamental’ o más recientemente como glicosaminoglicanos (GAG) y proteoglicanos.

Todos estos componentes juntos forman una red compleja en la que las células residen, se comunican y participan en diversas funciones celulares, como el crecimiento, la diferenciación y la migración (Theocharis et al., 2016).
La fascia, en su construcción, tiene una mayoría de componente no celular, por eso es parte de lo que llamamos matriz extracelular. Gracias a esto, mantiene unida cada parte de nuestro cuerpo y nos proporciona protección, tanto mecánica como química, formando una barrera física que actúa como un andamio y mecanismo de soporte, lo cuál es vital para permitir el movimiento de los fluidos intersticiales entre los que se encuentran muchos linfocitos (Earl, 2020).
En la imagen puedes apreciar una parte de tejido fascial en vivo con un aumento de 25x tomada con una cámara endoscópica por el Dr. J. C. Guimberteau
El tejido fascial, normalmente no tiene aire entre sus fibras, ya que habitualmente es un espacio continuo de compartimentos llenos de líquido. El espacio que aprecia en la imagen se debe a la interrupción por la cirugía y la presencia del endoscopio.

Las células
Las células más abundantes en los tejidos conectivos son los fibroblastos, que tienen funciones clave en la construcción y el mantenimiento de la matriz extracelular. Los fibroblastos, son en definitiva, los encargados de sintetizar el colágeno en el tejido conectivo.
La matriz extracelular
La matriz extracelular (MEC) es “la suma total de sustancia extracelular dentro del tejido conectivo” (Williams 1995). La podemos definir como un sustrato sobre el cual se construye todo lo demás en el cuerpo. La MEC contiene dos tipos fundamentales de moléculas: Las proteínas fibrosas y la sustancia fundamental (ground substance).
El componente fibroso es fundamental para transmitir la fuerza muscular (creada ya sea por contracciones musculares o por fuerzas externas), conectar diferentes segmentos y contener las estructuras (Turrina et al., 2013). Se compone, en su mayor parte, de fibras de colágeno (~80% de la proteína total, especialmente tipos I y III), que brinda un marco de soporte a los tejidos y las células, pero también contiene unas pocas fibras elásticas (elastina y fibrilina), que contrarrestan la cantidad de colágeno necesaria para permitir que los tejidos soporten el estiramiento y la distensión y permitan distribución de las tensiones que mantienen la resiliencia del tejido (Ushiki, 2002; Earl, 2020).
El componente fluido de la MEC se denomina sustancia fundamental, un entorno fluido y viscoso donde tienen lugar los intercambios químicos en el cuerpo y los intercambios moleculares entre la sangre, la linfa y los tejidos que suceden las células (Lesondak, 2017). Este componente acuoso se compone principalmente de agua, y se envuelve en una mezcla compleja de glicosaminoglicanos (GAG), generalmente unidos covalentemente a proteínas, formando los denominados proteoglicanos y glucoproteínas (Fede et al., 2021). En sí, es una especie de gel líquido que contiene agua junto con varios azúcares y proteínas.
Tejido conectivo areolar
Entre diferentes capas miofasciales, si bien están separadas en términos de profundidad, están conectadas entre sí por un diferente tipo de tejido fascial rico en líquido, conocido como tejido areolar o tejido conectivo laxo (fig. 1.25). El tejido areolar muy fluido contiene fibras de colágeno y elastina, como la fascia, pero dentro de un mayor concentración de sustancia fundamental (Earl, 2020).
Este proporciona la lubricación dentro del sistema que permite que cada capa se deslice sobre su vecina, conectándolas y facilitando el movimiento en función de la orientación al vector de fuerzas involucrado. Pero es propenso a cambios en la hidratación local, creando adherencias que inhiben el movimiento relativo entre los diferentes planos fasciales (Earl, 2020).

El colágeno
¿Qué es el colágeno?
El colágeno es la principal proteína estructural de la mayoría de los tejidos duros y blandos de los animales y del cuerpo humano, localizándose en el tejido conjuntivo (Lindsay 2008) y desempeña un papel importante en el mantenimiento de la integridad biológica y estructural de la matriz extracelular (MEC) y proporciona soporte físico a los tejidos (Dong & Lv, 2016)
El colágeno, una de las principales macromoléculas de la matriz extracelular, es el encargado de unir los tejidos conectivos del cuerpo. Así, está presente en huesos, cartílagos, ligamentos, piel, tejido hematológico, adiposo y en los órganos. Tiene un papel fundamental en la estructura e integridad del organismo.
SABÍAS QUÉ
El colágeno es la proteína más abundante de todo el organismo, representando alrededor del 25% del total de las proteínas (Tortora y Derrikson, 2011)
Estructura del colágeno
El colágeno tiene una arquitectura helicoidal la cuál le proporciona al tejido características elásticas. Contamos con 42 genes que codifican las cadenas de colágeno en el cuerpo humano.
Los aminoácidos glicina, prolina y hidroxiprolina constituyen el 57 % del total de aminoácidos del colágeno, que a su vez representa un tercio del total de las proteínas del cuerpo humano (Li & Wu, 2018). Los tres son aminoácidos no esenciales, es decir, el cuerpo puede sintetizarlos endógenamente, y utilizarlos después para sintetizar el colágeno.

Tipos de colágeno
Existen en nuestro cuerpo humano 28 colágenos diferentes, que dependen, entre otros factores, del tejido en el que actúe y de las sustancias con las que se combine. Los tipos I, II y III son los principales. El colágeno tipo I es, con diferencia, el colágeno más abundante en el cuerpo.
TIPO I: Se encuentra sobre todo en los huesos, la córnea, la dermis y los tendones y se presenta en forma de fibra con estrías que se agrupan y forman cadenas para dotar a los tejidos del organismo de elasticidad y resistencia.
TIPO II: Presente en los cartílagos, en algunas estructuras de los embriones y en el humor vítreo del ojo. Otorga resistencia a estos tejidos ante presiones intermitentes.
TIPO III: Está en los tejidos de los músculos, las venas y la piel. Actúa como sostén de los órganos que tienen la capacidad de expandirse y contraerse.
TIPO IV: Se encuentra principalmente en la piel. Su función es la de darle sostén y la capacidad de filtrar sustancias diferentes.
TIPO V: Presente principalmente en los órganos y en los tejidos situados en el interior del cuerpo. Su función se asocia con la del tipo I, es decir, otorga resistencia a los tejidos.
Funciones del colágeno
La principal función del colágeno es la de crear y mantener las estructuras de los tejidos que forman el organismo.
Siempre se ha asociado el colágeno a la piel, como decisivo para conservar su firmeza y flexibilidad, entre otras propiedades. Ahora también sabemos que el colágeno es importante en respuesta al movimiento y los estímulos mecánicos a los que sometemos a nuestro cuerpo, como detallaré más abajo.
Las propiedades de los diferentes tipos de fibras de colágeno varían de un tejido a otro (Tortora y Derrikson, 2011)
Síntesis de colágeno
La síntesis del colágeno es regulada por interacciones complejas que incluyen:
- Factores de crecimiento
- Hormonas
- Citosinas.
Hormona del crecimiento
La hormona del crecimiento humano (GDH), vinculada al crecimiento muscular, y que en su mayoría se sintetiza durante el sueño pero también con el entrenamiento asociado a la alta intensidad, es un importante requisito para la producción de colágeno. Kjaer y colaboradores (2009) demostraron un efecto claro en la producción de colágeno y la síntesis adecuada de colágeno en la renovación de los tejidos y su dependencia de un suministro suficiente de GDH, que actúa efectivamente como un importante fertilizante ( et al., 2009). Si quieres aprender más sobre la hormona del crecimiento puedes leer los siguientes artículos que te dejo enlazados a continuación.
- Hormonas y sistema endocrinoHormonas y sistema endocrino
- Entendiendo las hormonasEntendiendo las hormonas
La pérdida de colágeno
La edad
Es un hecho que la síntesis de colágeno disminuye a medida que sumamos años al carnet de identidad. Con el tiempo, los fibroblastos disminuyen gradualmente su actividad biológica, lo que interfiere en la tasa metabólica de colágeno sobre la matriz extracelular, que empieza a tener fibras menos densas y más débiles, lo que causa una pérdida de elasticidad (Mays et al., 1991).
SABÍAS QUÉ
Comenzamos a perder colágeno entre los 18 y los 29 años. A partir de los 40 años, la tendencia es a perder en torno al 1% de colágeno al año y a partir de los 80 años, la síntesis puede verse disminuida en un 75% en comparación con la de un adulto jóven (Varani et al., 2006; Baumann, 2007)
Envejecimiento de la piel
La piel es el órgano más grande del cuerpo humano y el colágeno, su principal componente. En la dermis, diversos estudios demuestran que el envejecimiento cronológico de la piel está relacionado con la síntesis reducida de colágeno tipo I y III (Morita, 2007). Sin embargo, esta disminución en la actividad de síntesis de colágeno, relacionada con la edad puede ser, al menos en parte, reversible (Varani et al., 2006).
Falta de sueño y descanso
La falta de sueño también afecta a la síntesis de colágeno. En una revisión de varios estudios realizada por Kahan y colaboradores (2010) se demuestra que el sueño desempeña un papel en la restauración de la función del sistema inmunitario y que los cambios en la respuesta inmunitaria pueden afectar la producción de colágeno.
Disminución de los estrógenos en la mujer
Un descenso en los niveles de estrógenos, como ocurre en las mujeres durante la menopausia, se vincula a una reducción de la síntesis de colágeno (Stevenson & Thornton, 2007) motivado por unos fibroblastos con menos desempeño. Los estudios indican que hasta el 30% del colágeno cutáneo se pierde en los primeros 5 años de la menopausia (Brincat et al., 1985)
La pérdida de tonicidad y espesor de la piel, la fragilidad cutánea y la aparición de sequedad y/o arrugas se vincula con los efectos de los estrógenos y cómo estos pueden aliviar los cambios debidos al envejecimiento de la piel.
Fibras de colágeno en el tejido de la fascia
En términos simples, la fascia es el tejido del cuerpo que mantiene unidas nuestras trillones de células húmedas y grasosas (Myers, 2021). El sistema fascial impregna el cuerpo, permitiendo que todos sus sistemas funcionen de manera integrada.
Todas las células de la fascia y cada componente de la matriz extracelular cumplen funciones específicas, pueden responder a diversos estímulos y pueden modularse.

Las fibrillas de colágeno (kóll = preparado adhesivo) se encuentran en la mayoría de los tipos de tejido conectivo. Están compuestas por más de un tipo de colágeno y son insolubles en agua. Son muy fuertes y resisten las fuerzas de tracción, pero no son rígidas, lo cual le confiere flexibilidad al tejido. A menudo, se disponen en haces paralelos, lo que le confiere al tejido mayor resistencia a la tensión (Tortora y Derrikson, 2011).
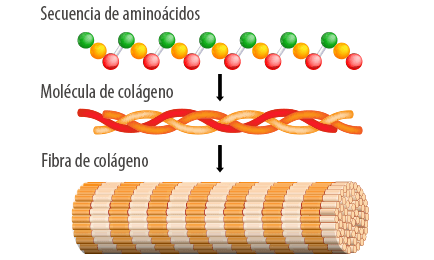
Esta triple hélice de fibras de colágeno le da a la fascia una gran resistencia a la fuerza de tracción, lo que significa que se puede estirar sin romperse (en su mayor parte) (Lesondak, 2017)
Viscoelasticidad entre las fibras de colágeno
Como como sugiere el nombre, la viscoelasticidad de cualquier material es una combinación de viscosidad y elasticidad. La viscosidad es la resistencia del material o tejido a deformarse, y la elasticidad es la capacidad del material o tejido para estirarse.
Una característica clave de los tejidos colágenos que promueven la eficiencia en el movimiento es su elasticidad, su capacidad para capturar energía y devolverla en el sistema, como un peso que rebota en un resorte (Earl, 2020). El colágeno, especialmente el que contiene fibras de tipo III, tiene la capacidad de alargarse bajo estrés y retroceder de una manera similar al de las bandas elásticas y los resortes.
Las propiedades viscoelásticas de el tejido fascial, serán determinantes para la fuerza que se puede producir en respuesta a una deformación.
Y no sólo el colágeno tiene propiedades viscoelásticas, la sustancia fundamental de la matriz extracelular, que llena los espacios entre las fibras y las células, puede variar en viscoelasticidad de relativamente flexible tejido conjuntivo laxo a cartílago más sólido.
SABÍAS QUÉ
La viscoelasticidad del tejido es determinada por la velocidad y el tiempo en que el tejido conectivo se deforma respondiendo a una carga
Fibras de colágeno y transmisión de fuerza
En la medicina clásica y los conceptos más habituales de la biomecánica, la función de los músculos en cuanto a la fuerza que generan se ha comprendido siempre al estudiar su origen, la inserción y la orientación de las fibras, sin considerar la aportación del tejido fascial.
En las últimas décadas, la ciencia ha constatado que existe una tensión elástica almacenada en la red de colágeno, lo que hace del colágeno un transmisor de fuerza, en otras palabras, la fascia facilita y modula la comunicación mecánica en todos los tejidos del cuerpo. Así lo avala un estudio realizado por Huijing (2007) que demostró cómo los músculos transmiten hasta el 40% de su contracción fuerza no en su tendón respectivo, sino más bien a través de conexiones fasciales en otros músculos que se colocan junto a ellos. Curiosamente, esto a menudo implica la transmisión de fuerza a antagonistas músculos, que luego se endurecen y tienden a aumentar la resistencia a este movimiento primario (Schleip & Klingler, 2021).
Los tejidos de colágenos transforman la energía cinética en energía potencial al absorber la energía y luego devolverla al sistema como energía cinética de nuevo. La transmisión y distribución de fuerza es el trabajo principal de la miofascia y la fascia profunda circundante (Myers, 2021). Para que la fuerza se transmita de manera eficiente y sana, las células fasciales remodelan constantemente la red de colágeno para equilibrar la necesidad de suficiente resistencia a la tracción, sin crear adherencias que reducen el movimiento a los tejidos vecinos o cerrando la perfusión a las células locales (Myers, 2021)
Adaptación de la fascia a los estímulos mecánicos
Para facilitar la transferencia de fuerza en los tejidos conectivos, la fascia se compone de la matriz extracelular (MEC), las proteínas estructurales las cuáles le confieren una alta resistencia a la tracción (Kjaer, 2004), la sustancia fundamental que aporta el agua en el tejido para proporcionar resistencia a la compresión y los fibroblastos, las principales células del tejido conectivo, los cuáles cambian constantemente su función metabólica según la tensión y estimulación de cizalla mecánica ejercida sobre ellos, gracias los detectores que contienen, y que es vital en la renovación de tejidos, porque así adaptan su actividad de remodelación de la matriz para que el la arquitectura del tejido responde aún mejor a la demandas, reaccionar a la tensión diaria, así como a estímulos específicos entrenamiento en un proceso de constante reconstrucción y reordenamiento de la red fascial (Kjaer et al., 2009; Schleip & Klingler, 2021).
Las fibras de colágeno Tipo I almacenan y liberan energía elástica pero necesitan estar conectadas y pegadas en la matriz extracelular. Esto se consigue gracias a la sustancia fundamental, un fluido que contiene polímeros de carbohidratos solubles. Estos polímeros toman estas fibras de proteína y las pegan juntos omnidireccionalmente (Parisi & Allen, 2021) proporcionando resistencia a la compresión.
¿Cómo responden las fibras de colágeno ante las cargas mecánicas?
En los tejidos biológicos, las fuerzas mecánicas influyen en una amplia gama de procesos celulares y moleculares. Si una célula o canal responde a una fuerza mecánica aplicada externamente o a una deformación o tensión local creada dentro del tejido por la fuerza, es una pregunta importante porque la misma cantidad de fuerza producirá más o menos deformación dependiendo de las propiedades viscoelásticas de el tejido (Langevin, 2021)
Ahora que sabemos que los músculos no actúan por sí solos ya que están encerrados dentro de una serie de envolturas ricas en colágeno, la miofascia, debemos conocer cuáles son los factores o características clave en la resiliencia de la fascia (Myers, 2021):
El patrón de la doble red de colágeno (especialmente en la miofascia)
La formación de rizos (especialmente en la porción tendinosa)
Las fascias sanas (imagen A, la de la izquierda) expresan una clara orientación bidireccional (retícula) de su red de fibra de colágeno. Además, las fibras de colágeno individuales muestran una formación de rizo más fuerte.
La falta de ejercicio, por otro lado, se ha demostrado que induce un efecto multidireccional en la red de fibras y una reducción en la formación de rizos, lo que lleva a una pérdida de elasticidad y retroceso elástico (imagen de la derecha, B).

Se denomina “Crimp” a la elasticidad ondulada del fibras de colágeno individuales que permiten su flexión-extensión adecuada a lo largo de la curva de tensión-deformación. Cuanto más regular sea la red, mejor será el rizado de las fibras de colágeno individuales.
El ejercicio adecuado con carga de las fibras, si se aplica regularmente, puede inducir una arquitectura de colágeno más juvenil. Esto recupera una disposición de fibra más ondulada (Wood et al., 1988; Jarniven et al., 2002; Como se citó en Schleip & Wilke, 2021) y expresa una capacidad de almacenamiento elástico significativamente mayor (Figuras 1.5, A) (Reeves et al., 2006; Witvrouw et al., 2007; Como se citó en Schleip & Wilke, 2021)
Sedentarismo y falta de estimulación mecánica en los tejidos de colágeno
La fascia resiliente reduce al mínimo el gasto de los músculos (Myers, 2021). La verdadera elasticidad parte de la capacidad de retroceso. El retroceso del tejido fascial proporciona esencialmente energía libre, y el músculo puede permanecer dentro de su relación fuerza-longitud óptima, a pesar de requerir determinada contracción muscular para mejorar o amortiguar estas energías según sea necesario.
La pérdida de retroceso elástico, o resorte, en los tejidos miofasciales se produce por un rizo más desorganizado y aleatorio (Fig 1.5.b). Esto puede estar motivado por el envejecimiento, pero también por la falta de estimulación mecánica, o sea, de movimiento y ejercicio físico.
Los experimentos han demostrado que la inmovilización conduce rápidamente a una desregulación en la estructura de la fibra y a un crecimiento multidireccional de enlaces cruzados adicionales entre la densidad de fibras de colágeno. En consecuencia, las fibras pierden su elasticidad, así como el suave movimiento de deslizamiento contrario entre sí, y luego se pegan formando adherencias tisulares con el tiempo y, en el peor de los casos, se enmarañan (Jarvinen et al., 2002).
Järvinen y colaboradores (2002) en estudios con animales muestran que la inmovilidad promueve enlaces cruzados en los tejidos fasciales, esencialmente haciéndolos pegados y enmarañados. Esto demuestra que los tejidos en este estado pierden su capacidad de deslizamiento, y eso implica una rigidez excesiva.
La importancia del agua en las fibras de colágeno
El agua es la otra parte clave de la ecuación en el tejido de la fascia. La fascia debe estar bien hidratada para permitir que sus fibras se muevan y se reorganicen.
Tenemos agua ligada o agua no ligada en nuestros tejidos. El agua libre consiste en moléculas de H2O que flotan y que no están unidas entre sí. El agua ligada es donde las moléculas de H2O están unidas entre sí y una superficie hidrofílica en su vecindad. Cuando eso pasa hay fuerte evidencia que sugiere que la fascia se vuelve más rígida y más dinámica porque es más resistente a la compresión (Pollack, 2001).
En resumen, deseamos que el agua entre en la fascia a unir moléculas. Esto se puede lograr a través de técnicas específicas de movimiento, estiramientos, automasaje sobre el rodillo de espuma, manipulación mecánica, comer comida real y fresca, bebiendo mucha agua, junto con otras estrategias (Parisi & Allen, 2021)
Como deportista, queremos una fascia con la rigidez adecuada pero también dinámica, como si nos pusiéramos un traje de compresión interna que liberase energía, gracias a ese ajuste y a la elasticidad.

SABÍAS QUÉ
La fascia contiene el 23% de agua de nuestro organismo y representa en torno a un 16% de nuestro peso total
Colágeno y mecanoadaptación
¿Qué es la mecanoadaptación y dónde se produce?
Una señal mecánica que genera un cambio celular se denomina mecanotransducción. El tejido fascial se remodela continuamente en hebras de colágeno de triple hélice producidas por miles de diminutas células fibroblásticas que se organizan a lo largo de las líneas de carga y el estrés en la matriz extracelular del cuerpo usando un proceso biológico llamado mecanotransducción (Ingber, 1998), la forma en que la célula percibe los estímulos generados en el tejido.
El movimiento y la aplicación de estímulos con cargas ya sean internos como externos, estimulan las fibras de colágeno y la matriz extracelular, lo que desencadena procesos tanto físicos como químicos que mejoran la red fascial en los tejidos estimulados.
Ley de Wolff
La Ley de Wolf establece que el hueso se adaptará a las cargas regulares colocadas sobre él, haciéndose más fuerte con el tiempo. Se le denomina así por Julius Wolff (marzo 21, 1836 – febrero 18, 1902), un cirujano alemán, aunque originalmente se llamó Ley de transformación del hueso, descubierta para describir las influencias mecánicas sobre el tejido óseo trabecular.
Cuando la carga a la que se expone un hueso aumenta regularmente, el entramado tridimensional de trabéculas óseas ramificadas que contiene una matriz de fibras colágenas paralelas entre sí, se adapta volviéndose más grueso y fuerte. Los osteoblastos, formadores de hueso, se ponen a trabajar, mientras mantienen alejados a los osteoclastos, los devoradores de hueso.

Ley de Davis aplicada en los tejidos de colágeno
Si bien la Ley de Wolff fue originalmente desarrollada con su enfoque principal en tejidos óseos, la Ley de Davis aplica este principio general en particular a los tejidos conjuntivos colágenos, estableciendo que los tejidos conectivos densos son capaces de adaptar su morfología a la carga mecánica. En definitiva, la fascia responde en función de la demanda mecánica de manera similar a lo que ocurre en el tejido conectivo óseo, siempre que estas demandas son lo suficientemente fuertes y ocurren de manera regular.
Bajo esta premisa, los fibroblastos se adaptan ante la estimulación mecánica experimentada: trabajan doble, sacan más colágeno cuando es necesario y secretan colagenasa, una enzima que come colágeno, todo basado en señales de presión y vibración (Lesondak, 2017).
SABÍAS QUÉ
Los vikingos parecen tener más fibroblastos y, por lo tanto, se coloca más fascia en el cuerpo, por lo que se conserva la flexibilidad es un desafío para el vikingo. Los mismos fibroblastos tomarán carga de una herida y tejer juntos rápidamente. Los bailarines, por otro lado, tienen menos fibroblastos, y por lo tanto más flexibilidad, menos estabilidad articular, y toman más tiempo para que las heridas cicatricen.
Estimula el desarrollo de colágeno con ejercicio
La estimulación biomecánica es al menos tan importante para la salud de los tejidos como el entorno bioquímico. Una adecuada red de colágeno aumenta la eficiencia del movimiento al disminuir la tensión en las partes individuales y aumentar la comunicación entre los músculos afectados y la fascia (Myers, 2021)
El entrenamiento de fuerza puede estimular la síntesis de hormona del crecimiento (GH), sobre la que ya mencionamos, que puede mejorar la síntesis de las proteínas de colágeno, lo que sugiere una mejor transmisión de fuerza y permitir el uso de cargas más altas durante una sesión de fuerza, lo que a su vez estimulará una mayor síntesis de proteínas musculares.
Podemos mejorar la resiliencia del tejido fascial y aumentar la elasticidad de los tejidos fasciales a través del entrenamiento adecuado, lo que puede tener una repercusión en la recuperación de lesiones y en la prevención. Esto incluye ejercicios que contengan un retroceso elástico y debemos considerar premisas individuales. Entraré en más detalle sobre esto en otro artículo.
Fuentes y suplementos de colágeno

El cuerpo tiene la capacidad de crear colágeno pero nosotros tenemos dos formas de ayudarle a tener más capacidad y más cantidad, a través de la comida y a través de la suplementación. Cuando lo digerimos, al igual que cualquier otra proteína, se descompone en sus aminoácidos que serán utilizados posteriormente por el cuerpo para construir las estructuras que necesite. Voy a hablar un poco por encima de las principales fuentes de colágeno y de los suplementos más conocidos y que tienen ciencia detrás. Las intervenciones nutricionales y/o de ejercicio que aumentan la síntesis de colágeno y fortalecen estos tejidos podrían tener un efecto importante en las tasas de lesiones.
Varios estudios sugieren la práctica de actividad física después de una comida rica en colágeno o de suplementación. Es decir, no vale sólo con la ingesta y quedarte en el sofá de casa. La practica de una actividad o un movimiento que genera una tensión mecánica le indica al organismo donde necesita aumentar la síntesis de colágeno. Por ejemplo en este estudio realizado en 2017 por Shaw y su equipo de colaborares, los participantes saltaban a la comba durante seis minutos, una hora después de tomar gelatina combinada con vitamina C, con el objetivo de estimular la síntesis de nuevo colágeno, alcanzando buenos resultados (estudio)
Fuentes de colágeno
La principal fuente de colágeno está en el reino animal. No está presente en el mundo vegetal. Lo encontramos en zonas poco digeribles como en partes del cerdo (oreja, morro, patas, lengua o la piel) o los cartílagos de la carne. Antiguamente estas partes se cocinaban mediante un hervido prolongado para extraer sus preciados nutrientes, así nació el famoso “caldo de huesos”, muy rico en colágeno. También lo podemos encontrar en los pescados, principalmente pescados azules, en partes que no se suelen comer como la piel o las espinas de los pescados. El caldo de pescado, por supuesto, también es rico en colágeno.
La gelatina es una gran fuente de colágeno, que puede ser útil para acelerar la reparación de los tejidos. Si la vas a consumir debes buscar una gelatina pura, es decir, sin saborizantes ni azúcar. Un estudio llevado a cabo por Gregory y colaboradores (2017) concluyen que la ingesta de gelatina a la par de un programa de ejercicio intermitente mejora la síntesis de colágeno y podría desempeñar un papel beneficioso en la prevención de lesiones y la reparación de tejidos.
Cuando los caldos se enfrían, se quedan sólidos, así se descubrió la gelatina, que es básicamente colágeno cocinado, o dicho de forma más científica colágeno parcialmente hidrolizado. Ésta, todavía se puede hidrolizar más en péptidos, obteniendo colágeno totalmente hidrolizado. Mientras que la gelatina se disuelve solo en agua caliente, los péptidos lo hacen también en frío.

Suplementos de colágeno
¿Por qué debería añadir un suplemento de colágeno a mi alimentación? En realidad no es una necesidad, es una opción, que atiende a circunstancias individuales o al propio contexto en que puede encontrar una persona, desde sufrir una lesión, patologías de la piel o dolor articular, o mismo el envejecimiento. Lo que sucede con la suplementación es que la hay buena y mala.
De forma general, en la suplementación de colágeno suelen combinarse otras sustancias para potenciar sus efectos, mejorar su eficacia, su asimilación por parte del organismo… Como puede ser el magnesio, el ácido hialurónico o la vitamina C. También existen extractos de algunos vegetales que demuestran estimular los fibroblastos, que te recuerdo son las células encargadas de sintetizar colágeno en el tejido conectivo.

Colágeno hidrolizado
El colágeno hidrolizado es mucho más asimilable para el cuerpo. El proceso natural de hidrolisis rompe aún más las moléculas para que nuestro cuerpo las asimile mejor y facilite su llegada a los tejidos conectivos que lo necesitan. La molécula original de colágeno es de alto peso molecular, lo cual dificulta su absorción (estudio). Se vende en una enorme variedad de formas, principalmente a modo de polvos o bien gránulos. Se requiere una dosis de 8-10 gramos diarios de colágeno hidrolizado.

Te dejo a continuación varios estudios de suplementación de colágeno hidrolizado con fines de paliar el dolor articular o mantener la masa magra.
- En el siguiente estudio se demuestra que el hidrolizado de colágeno de bajo peso molecular (LMW-CH) administrado en ratas ejerce un efecto beneficioso sobre la osteoporosis al aumentar el contenido de sustancia orgánica del hueso (estudio)
- Los estudios clínicos sugieren que la ingestión de 10 g de colágeno hidrolizado al día reduce el dolor en pacientes con artrosis de rodilla o cadera (Moskowitz, 2000)
- Un suplemento de proteína de colágeno hidrolizado, fortificado y concentrado mantuvo el equilibrio de nitrógeno y preservó la masa corporal magra durante 15 días de consumo de una dieta relativamente baja en proteínas (estudio).
Hidrolizado de gelatina
El hidrolizado de gelatina es un tipo de gelatina a la que se le han eliminado la mayoría de sus aminoácidos para facilitar la asimilación por parte del organismo.
Vitamina C
La vitamina C (VitC) juega un papel relevante en la síntesis de colágeno. La vitamina C desempeña un papel fundamental en el mantenimiento de una red normal de colágeno maduro en humanos (propiedades contra el escorbuto) al prevenir la autoinactivación de enzimas clave en la biosíntesis del colágeno (Boyera et al., 1998)
Los estudios preclínicos demostraron que la vitamina C tiene el potencial de acelerar la curación ósea después de una fractura, aumentar la síntesis de colágeno tipo I y reducir los parámetros de estrés oxidativo (DePhillipo et al., 2018)
Extractos de Boswelia y Centella asiática
Algunos extractos vegetales, como la Boswellia y la Centella asiática, demostraron en estudios preliminares poder estimular los fibroblastos y mejorar el aspecto de la piel (estudio), (estudio), (estudio)
¿Cómo se toma el suplemento de colágeno?
En general, los estudios sugieren que una dosis diaria de entre 2.5 a 15 gramos de colágeno hidrolizado puede ser eficaz para mejorar la salud de la piel, articulaciones, y huesos. Este suplemento se puede tomar en polvo, cápsulas o incluso en líquidos, y es común mezclarlo con agua, batidos o zumos para facilitar su ingesta.
El momento ideal para tomar colágeno no está completamente estandarizado, pero algunos expertos sugieren tomarlo en la mañana en ayunas o antes de dormir para facilitar su absorción. Además, consumir colágeno junto con una fuente de vitamina C puede mejorar su síntesis.

Conclusiones sobre el colágeno
Todas las células de la fascia y cada componente de la matriz extracelular cumplen funciones específicas, pueden responder a diversos estímulos y pueden modularse. En este artículo hemos tratado como el envejecimiento, el ejercicio, la nutrición y los factores hormonales pueden afectar el sistema fascial.
Unos hábitos de vida saludables, que incluyan una alimentación sana y equilibrada, la práctica de ejercicio físico y un adecuado descanso, son requisitos para que el tejido fascial mantenga sus propiedades. Un mayor aporte de colágeno en la alimentación o la suplementación pueden ser un extra a considerar en casos particulares, ayudando a mejorar la piel, paliar patologías óseas y articulares
Hasta ahora no se ha tenido en cuenta el papel principal que los tejidos conectivos colágenos tienen en deportes asociados con lesiones por uso excesivo. El adecuado entrenamiento del tejido fascial y el aporte nutricional o suplementación apropiada pueden ser de gran utilidad en la mejora del rendimiento, en el tratamiento de lesiones o en su recuperación.
Continuaré en próximas entradas hablando sobre la fascia, si bien, entender la importancia del colágeno en este tejido es necesario para lo que voy a continuar desarrollando. Gracias por tu tiempo y espero que continúes en próximas lecturas.
CONTACTO
Referencias
Avison, J. 2021. Fascial form in yoga. En Schleip, R. & Wilke J. (Ed.) Anatomy trains in motion. 2ª Ed. Handspring Publishing.
Baumann L. (2007). Skin ageing and its treatment. The Journal of pathology, 211(2), 241–251. https://doi.org/10.1002/path.20
Dennenmoser, S. 2021. Three-dimensional fascia-oriented training. En Schleip, R. & Wilke J. (Ed.) Fascia in sport and movement. 2ª Ed. Handspring Publishing.
DePhillipo NN, Aman ZS, Kennedy MI, Begley JP, Moatshe G, LaPrade RF. Efficacy of Vitamin C Supplementation on Collagen Synthesis and Oxidative Stress After Musculoskeletal Injuries: A Systematic Review. Orthop J Sports Med. 2018 Oct 25;6(10):2325967118804544. doi: 10.1177/2325967118804544. PMID: 30386805; PMCID: PMC6204628.
Dischiavi, S.L., Wright, A.A., Hegedus, E.J. & Bleakley, C.M. (2018) Biotensegrity and myofascial chains: a global approach to an integrated kinetic chain. Med Hypotheses. 110: 90–96
Dong, C.; Lv, Y. Application of Collagen Scaffold in Tissue Engineering: Recent Advances and New Perspectives. Polymers 2016, 8, 42. https://doi.org/10.3390/polym8020042
Earl, J. 2020. Born to walk: Myofascial efficiency and the body in movement. North Atlantic Books
Fuller, B. (1975) Synergetics. New York, NY: Macmillian, Chapter 7.
Gonzáles Badillo, J.J., & Ribas, J. (2002) Bases de la programación del entrenamiento de la fuerza. Barcelona: Inde.
Gregory Shaw, Ann Lee-Barthel, Megan LR Ross, Bing Wang, Keith Baar, Vitamin C–enriched gelatin supplementation before intermittent activity augments collagen synthesis, The American Journal of Clinical Nutrition, Volume 105, Issue 1, January 2017, Pages 136–43, https://doi.org/10.3945/ajcn.116.138594
Hashizume, S., Iwanuma, S., Akagi, R., Kanehisa, H., Kawakami, Y. & Yanai, T. (2014) The contraction-induced increase in Achilles tendon moment arm: a three-dimensional study. J Biomech. 47: 3226–3231
Huijing, P.A. (2007) Epimuscular myofascial force transmission between antagonistic and synergistic muscles can explain movement limitation in spastic paresis. J Electromyogr Kinesiol. 17: 708–724.
Ingber, D. (1998) The architecture of life. Scientific American. January: 48–57.
Jarvinen, T.A., Jozsa, L., Kannus, P., Jarvinen, T.L., & Jarvinen, M. (2002) Organization and distribution of intramuscular connective tissue in normal and immobilized skeletal muscles. An immunohistochemical, polarization and scanning electron microscopic study. J Musc Res Cell Mot. 23: 245–254.
Kahan, V., Andersen, M. L., Tomimori, J., & Tufik, S. (2010). Can poor sleep affect skin integrity?. Medical hypotheses, 75(6), 535–537. https://doi.org/10.1016/j.mehy.2010.07.018
Kawakami, Y., Muraoka, T., Ito, S., Kanehisa, H. & Fukunaga, T. (2002) In vivo muscle fibre behaviour during countermovement exercise in humans reveals a significant role for tendon elasticity. J Physiol. 540: 635–646.
Kjaer, M., Langberg, H., Heinemeier, K., Bayer, M.L., Hanse, M., Holm, L., Doessing, S., Kongsgaard, M., Krogsgaard,
M.R., & Magnusson, S.P. (2009) From mechanical loading to collagen synthesis, structural changes and function in
human tendon. Scand J Med Sci Sports. 19: 500–510.
Langevin, H.M. Fascia Mobility, Proprioception, and Myofascial Pain. Life 2021, 11, 668. Fascia Mobility, Proprioception, and Myofascial Pain
Lesondak, D. 2017. Fascia: What it is and why it matters. Handspring Ed.
Levin, S. (2003) The tensegrity-truss as a model for spine mechanics. J Mech Med Biol. 2: 374–388
Li, P., & Wu, G. (2018). Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth. Amino acids, 50(1), 29–38. https://doi.org/10.1007/s00726-017-2490-6
Maas, M. & Sandercock, T.G. (2010) Force transmission between synergistic skeletal muscles through connective tissue. Journal of Biomedicine and Biotechnology. April 12.
Matteini, Paolo & Dei, Luigi & Carretti, Emiliano & Volpi, Nicola & Goti, Andrea & Pini, Roberto. (2009). Structural Behavior of Highly Concentrated Hyaluronan. Biomacromolecules. 10. 1516-22. 10.1021/bm900108z.
Mays PK, McAnulty RJ, Campa JS, Laurent GJ. Age-related changes in collagen synthesis and degradation in rat tissues. Importance of degradation of newly synthesized collagen in regulating collagen production. Biochem J. 1991 Jun 1;276 ( Pt 2)(Pt 2):307-13. doi: 10.1042/bj2760307. PMID: 2049064; PMCID: PMC1151092.
Morita A. (2007). Tobacco smoke causes premature skin aging. Journal of dermatological science, 48(3), 169–175. https://doi.org/10.1016/j.jdermsci.2007.06.015
Moskowitz, R., 2000. Role of collagen hydrolysate in bone and joint disease. Seminars in Arthritis and Rheumatism. Volume 30, Issue 2,Pages 87-99, ISSN 0049-0172, https://doi.org/10.1053/sarh.2000.9622.
Myers, T. 2021. Fascial stretching. En Schleip, R. & Wilke J. (Ed.) Anatomy trains in motion. 2ª Ed. Handspring Publishing.
Parisi, B. and Allen, J. 2021. Periodized fascia training for speed, power and injury resilience. En Schleip, R. & Wilke J. (Ed.) Anatomy trains in motion. 2ª Ed. Handspring Publishing.
Peña, G. (2013). stiffness (muscular) (rigidez muscular).http://g-se.com/es/salud-y-fitness/wiki/stiffness-muscular_9553.
Pollack, G.H. (2001) Cells, Gels, and the Engines of Life. A New, Unifying Approach to Cell Function. Seattle, Washington: Ebner and Sons Publishers.
Reeves, N.D., Narici, M.V., & Maganaris, C.N. (2006) Myotendinous plasticity to aging and resistance exercise in humans. Exp Physiol. 91: 483–498.
Shaw, G., Lee-Barthel, A., Ross, M. L., Wang, B., & Baar, K. (2017). Vitamin C-enriched gelatin supplementation before intermittent activity augments collagen synthesis. The American journal of clinical nutrition, 105(1), 136–143. https://doi.org/10.3945/ajcn.116.138594
Schleip R., Findley T., Chaitow L., Huijing P. 2012. Fascia: The Tensional Network of the Human Body. The science and clinical applications in manual and movement therapy
Schleip R., Wilke J. 2021. Fascia in Sport and Movement
Schleip R., Klingler W. 2021. Highlights of fascial anatomy, morphology and function. Schleip R., Wilke J. Fascia in sport and movement.
Stevenson S, Thornton J. Effect of estrogens on skin aging and the potential role of SERMs. Clin Interv Aging. 2007;2(3):283-97. doi: 10.2147/cia.s798. PMID: 18044179; PMCID: PMC2685269.
Theocharis, A.D.; Skandalis, S.S.; Gialeli, C.; Karamanos, N.K. Extracellular matrix structure. Adv. Drug Deliv. Rev. 2016, 97, 4–27. [Google Scholar] [CrossRef] [PubMed]
Tortora, G. J., & Derrickson, B. (2011). Principios de anatomía y fisiología. 13º Edición. Ed: Panamericana.
Turrina, A.; Martínez-González, M.A.; Stecco, C. The muscular force transmission system: Role of the intramuscular connective tissue. J. Bodyw. Mov. Ther. 2013, 17, 95–102. [Google Scholar] [CrossRef] [PubMed]
Ushiki, T. Collagen fibers, reticular fibers and elastic fibers. A comprehensive understanding from a morphological viewpoint. Arch. Histol. Cytol. 2002, 65, 109–126. [Google Scholar] [CrossRef] [PubMed][Green Version]
Varani J, Dame MK, Rittie L, Fligiel SE, Kang S, Fisher GJ, Voorhees JJ. Decreased collagen production in chronologically aged skin: roles of age-dependent alteration in fibroblast function and defective mechanical stimulation. Am J Pathol. 2006 Jun;168(6):1861-8. doi: 10.2353/ajpath.2006.051302. PMID: 16723701; PMCID: PMC1606623.
Witvrouw, E., Mahieu, N., Roosen, P., & McNair, P. (2007) The role of stretching in tendon injuries. Br J Sports Med. 41: 224–226
Wood, T.O., Cooke, P.H., & Goodship, A.E. 1988. The effect of exercise and anabolic steroids on the mechanical properties and crimp morphology of the rat tendon. Am J Sports Med. 16: 153–158
Zaidel-Bar, R., Itzkovitz, S., Ma’ayan, A., Iyengar, R. & Geiger, B. (2007) Functional atlas of the integrin adhesome. Nat Cell Biol. 9: 858–867.
Zamir, E. & Geiger, B. (2001) Molecular complexity and dynamics of cell-matrix adhesions. J Cell Sci. 114: 3583–3590

Educador Físico Deportivo. Graduado en Ciencias de la Actividad Física y del Deporte. Colegiado nº 64.218. Máster en Prevención y Readaptación de Lesiones Deportivas en el Fútbol por la UCLM y la RFEF. Máster en Cineantropomería y Nutrición Deportiva por la UV. Técnico Superior en Dietética y Técnico Superior de Fútbol (UEFA Pro). Apasionado del fitness y como deporte futbolero. Tengo la suerte de ayudar a personas a mejorar su salud a través del ejercicio.



